精准控制生物体神经电活动对于临床神经疾病治疗和基础科学研究都至关重要。临床上通过手术在脑或脊髓植入电极刺激特定神经组织,可治疗帕金森和疼痛等疾病;在神经科学基础研究中,光遗传学采用病毒转染或转基因的方法在特定神经元过表达外源性光敏感离子通道,并通过手术植入光纤实现对动物神经环路的光刺激和调控。由于这些技术需要手术植入电极或光纤以及过表达外源性工具蛋白,实施起来具有一定的侵入性,增加了临床治疗和实验研究的风险和复杂性。而内源性离子通道是神经电信号产生、传播和整合的基础,因此若能以非侵入的方式实现对神经内源性离子通道的精准控制,就可能实现无创的在体神经调控。
近日,广州医科大学王树教授团队在Science系列期刊Science Advances在线发表题为“Remote neurostimulation through an endogenous ion channel using a near-infrared light–activatable nanoagonist”的研究论文,首次报道使用组织穿透力更强的近红外光对活体小鼠的特定内源性神经离子通道的精准遥控,以无创的方式实现对小鼠疼痛的神经调控。王树课题组联合广州医科大学侯智尧课题组、哥伦比亚大学杨建课题组和上海长征医院肖建如团队将光药理学和纳米技术相结合,构建了首个可被近红外光激活的离子通道配体去实现这一无创神经调控。

首先,研究人员以痛觉感受神经离子通道TRPA1为靶点,开展了TRPA1光敏感配体分子的筛选,首次发现黄素类化合物(如黄素腺嘌呤二核苷酸FAD)在UVA至蓝光波长范围内的光照下可以激活TRPA1离子通道(图1)。
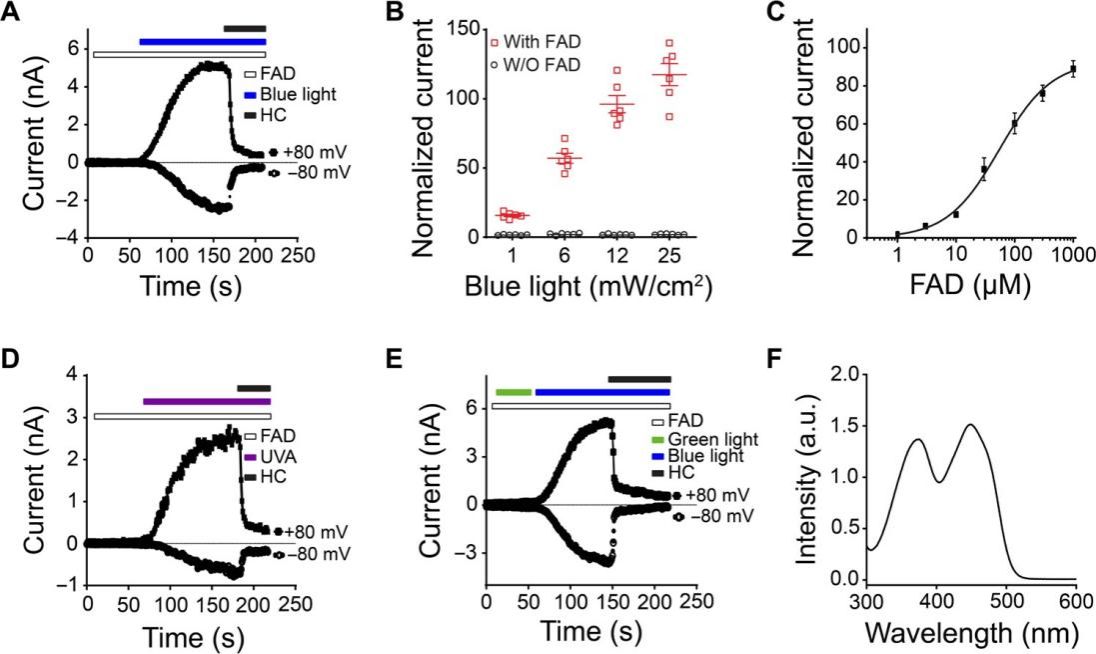
图1. 黄素腺嘌呤二核苷酸(FAD)使TRPA1可以被UVA/蓝光激活
研究者进一步使用药理学工具、蛋白点突变和膜片钳记录等技术解析了FAD对TRPA1的光激活机制。FAD分子在光照下发生单重态和三重态的跃迁,三重态FAD可以直接作用于TRPA1蛋白,产生氨基酸残基自由基,同时三重态FAD也可与氧气相互作用生成单线态氧间接作用于TRPA1蛋白(图2)。通过以上光化学作用最终引起通道的开放,TRPA1蛋白氨基酸残基M912和H983在此光化学反应引起的通道开放中起关键作用(图2)。
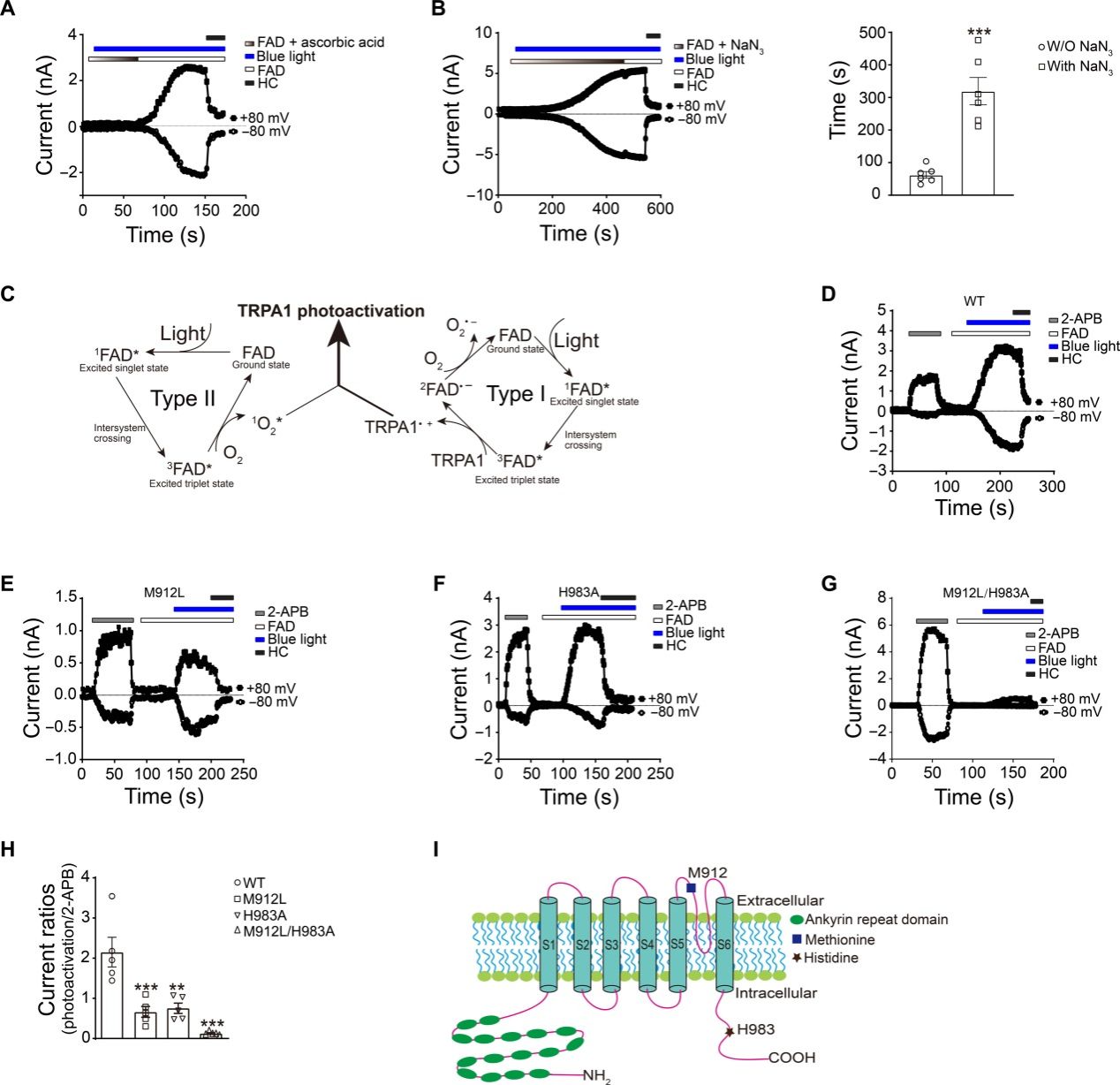
图2. TRPA1的光激活依赖于FAD介导的光化学反应
小鼠皮内注射FAD后,使用小鼠可穿戴UVA/蓝光光源去光激活特定部位皮肤神经末梢的TRPA1通道,可实现对自由活动小鼠抓挠行为可逆和可重复的光控制(图3),表明FAD可用于神经TRPA1通道的在体光调控。
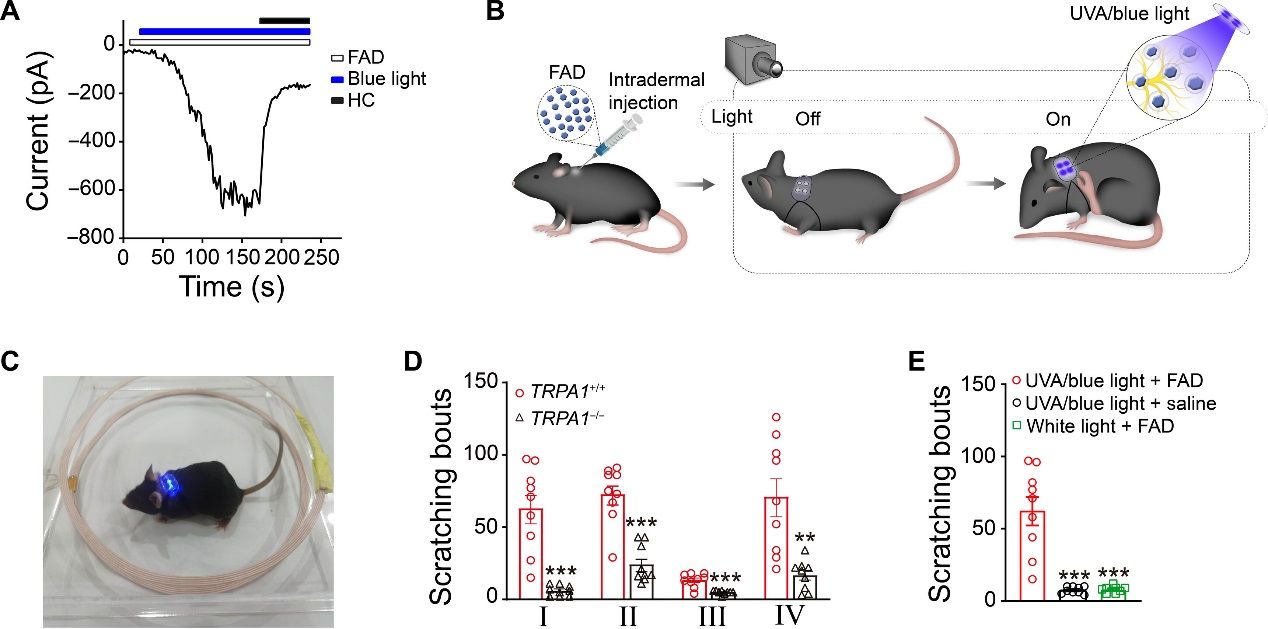
图3. UVA/蓝光通过FAD可逆和可重复地控制TRPA1介导的小鼠抓挠行为
UVA/蓝光的组织穿透力有限,仅能穿透皮肤到达支配皮肤的神经末梢。与之相比,近红外光具有较低的生物组织吸收度和较高的组织穿透性,因此研究者进一步合成了可将808纳米近红外光转换为UVA/蓝光的上转换纳米材料(UCNPs),其UVA/蓝光发射光谱和FAD吸收光谱相一致。将UCNPs和FAD分子连接后即构建成为一个对近红外光敏感的纳米光化学激动剂UCNP-FAD(图4)。
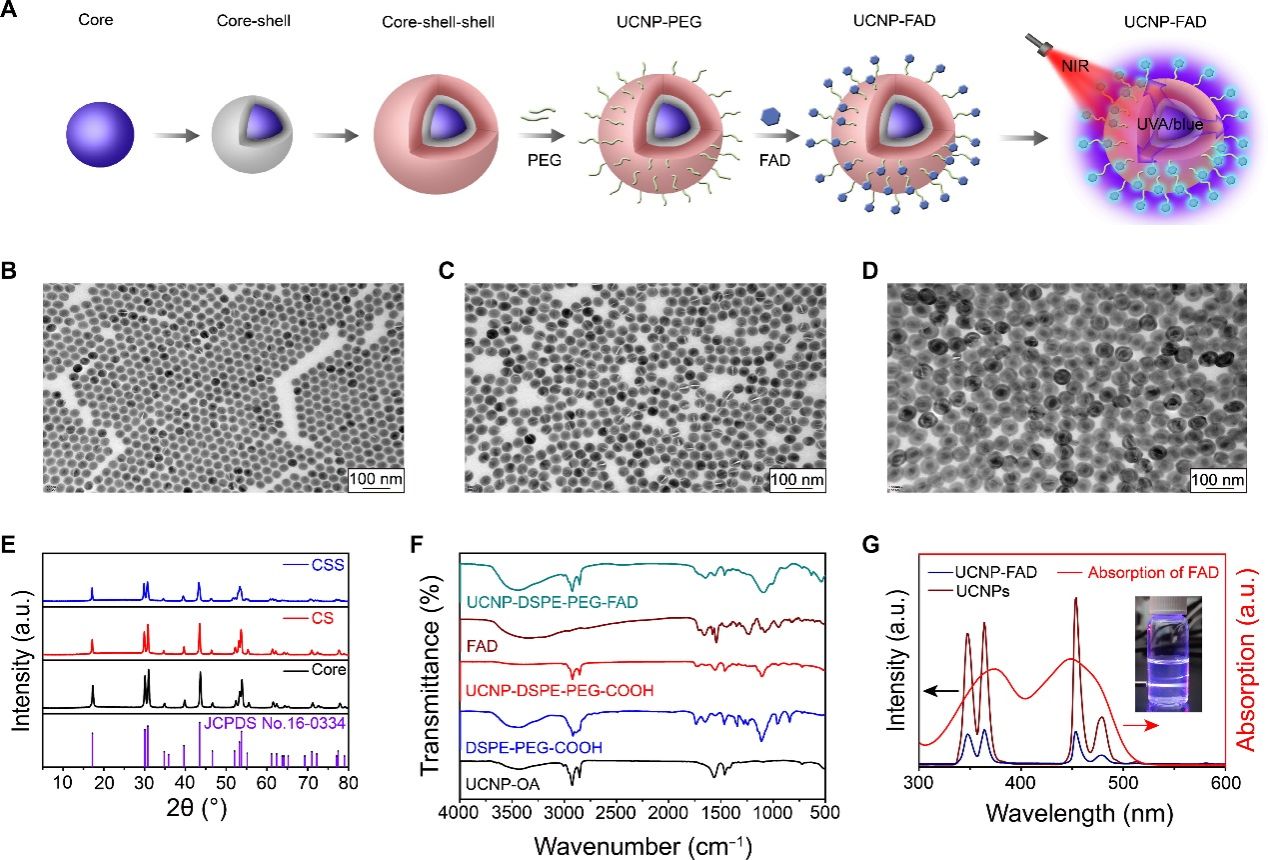
图4. 合成对近红外光敏感的纳米光化学激动剂UCNP-FAD
在组织穿透力更强的808纳米近红外光照射下,UCNP-FAD中的UCNPs可将近红外光转换为UVA/蓝光,进而激活连接的FAD分子,最终实现对TRPA1通道的近红外光激活(图5)。小鼠皮内注射UCNP-FAD后,可实现近红外光对皮肤神经末梢TRPA1的激活以及对TRPA1介导的小鼠抓挠行为的神经调控(图6)。
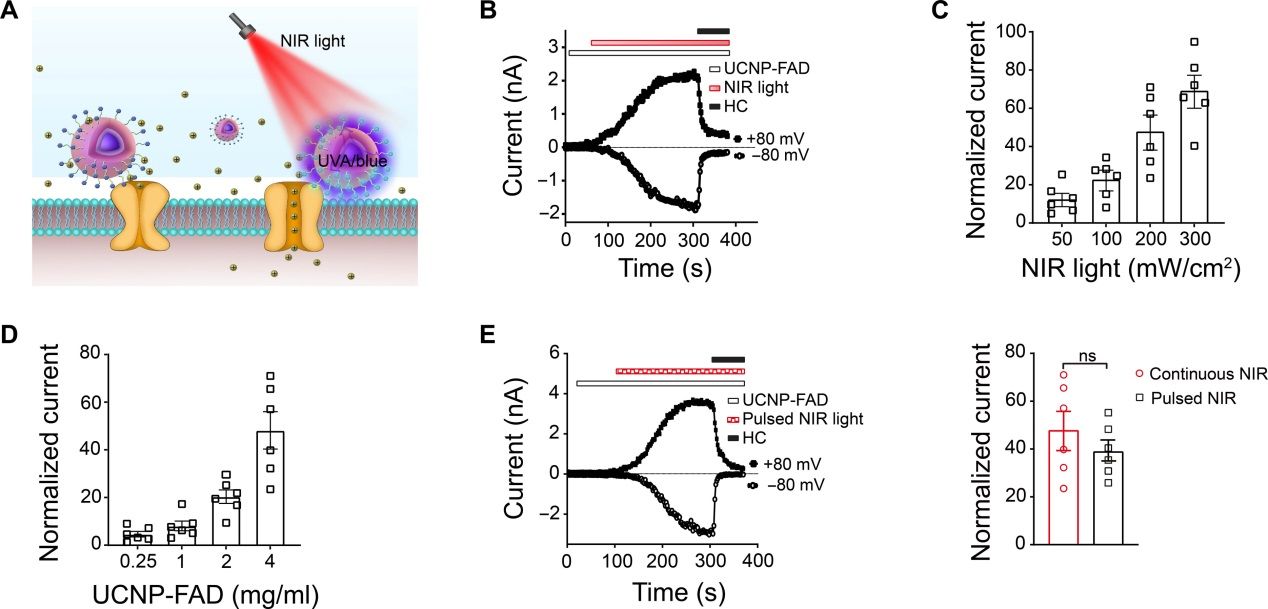
图5. UCNP-FAD使TRPA1可以被808纳米近红外光激活
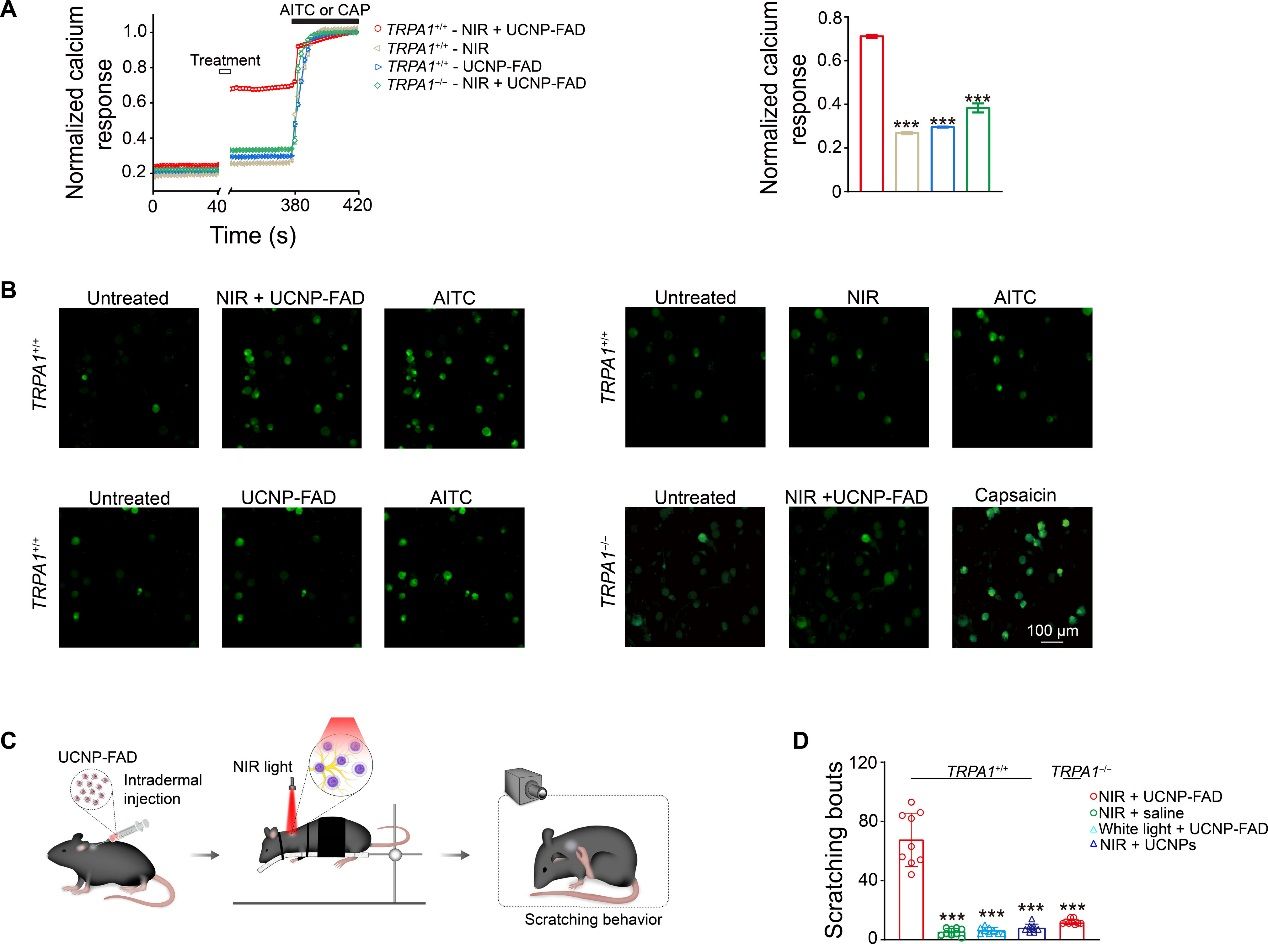
图6.UCNP-FAD实现近红外光对外周神经末梢TRPA1介导的小鼠抓挠行为的调控
由于TRPA1不仅表达在皮肤痛觉神经末梢,它同样表达在痛觉感受神经纤维位于脊髓的中枢端,参与调控痛觉神经信号的在脊髓的传导。研究者在小鼠鞘内注射UCNP-FAD后,使用近红外光光源从体外照射小鼠脊髓的特定部位,即可以非侵入式的方式实现对小鼠脊髓特定位置TRPA1通道激活。使用不同强度近红外光照射可引起脊髓TRPA1不同程度的激活,从而实现对活体小鼠疼痛行为的无创双向调控,即诱导小鼠痛觉过敏或者抑制疼痛(图7,8)。
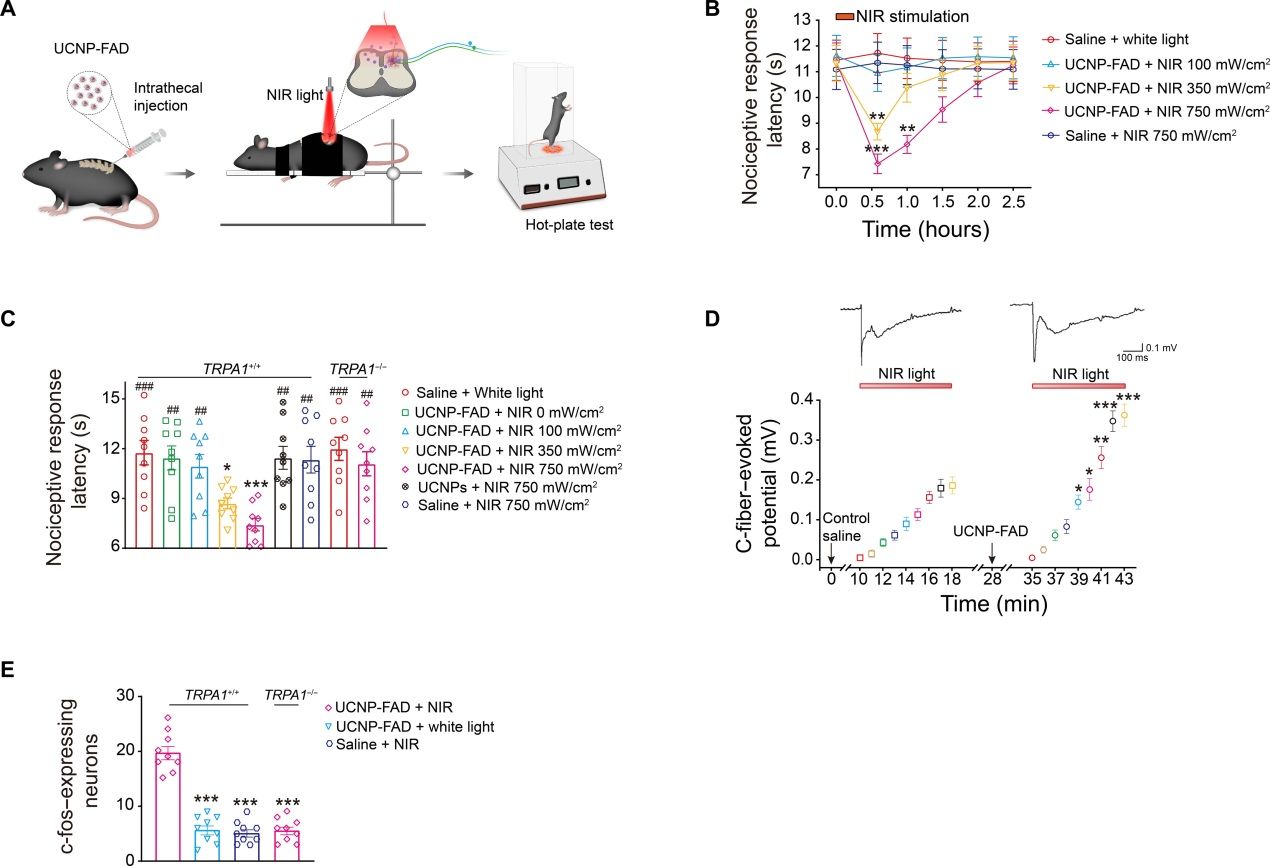
图7. 近红外光通过UCNP-FAD远程诱导脊髓TRPA1介导的小鼠热痛觉过敏
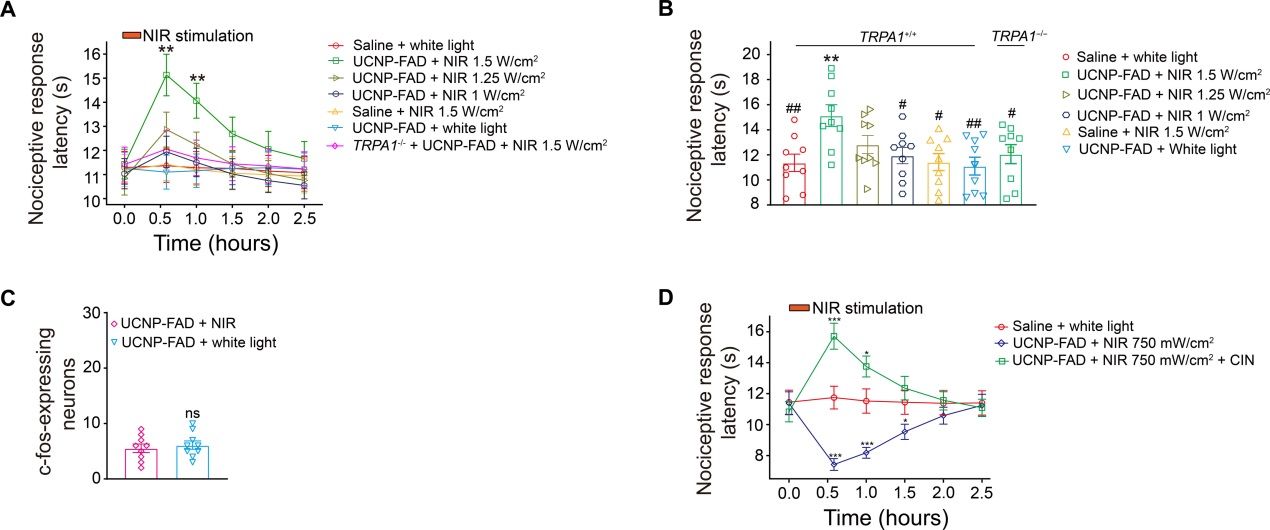
图8. 高强度近红外光通过UCNP-FAD强烈激活小鼠脊髓内TRPA1引起镇痛作用
结论与讨论,启发和展望
研究者展示了一种不需要基因修饰、非侵入式的神经调控方法。首次证明UCNPs耦合的光药理学工具可以实现近红外光对神经内源性离子通道的激活以及内源性通道介导的无创神经调控。随着离子通道光药理学工具库的不断扩大,以及各种吸收和发射光谱UCNPs的合成,未来通过将不同离子通道的光药理学工具与发射光谱相匹配的UCNPs相结合,可使该技术方法应用于各种内源性离子通道和神经功能的精准无创调控,为基础神经科学研究、神经系统疾病和离子通道病的治疗提供一种新的方法和途径。
文章链接:https://www.science.org/doi/10.1126/sciadv.adn0367
1958-2025 广州医科大学
技术支持:信息与数据管理中心 学校地址:广州市番禺区新造镇(番禺校区),广州市东风西路195号(越秀校区) 邮编:511436